妊孕性/妊孕性温存について
女性の方へ
ART治療について
採卵方法
この内容については準備中です。
受精方法
この内容については準備中です。
体外培養
はじめに
体外受精や顕微授精が行われ、受精が確認された受精卵(胚)は、胚移植あるいは胚凍結まで培養液の中で発育させる胚培養が行われます。自然妊娠における受精から着床までの期間は卵管から子宮内腔という低酸素環境で経過するため、体外培養ではできるだけそれに近い状態を作り出すことが必要です。ここでは、培養環境やその間の胚発育について説明します。
胚発育
採卵された卵子は、通常周囲を顆粒膜細胞(卵丘細胞)に囲まれた状態で、完全に成熟させるまで3〜6時間程度の前培養をへて、媒精が行われます。媒精後17〜20時間に、細く引き伸ばしたパスツールピペットで卵子周囲の卵丘細胞を除去した後、受精の有無の確認が行われます。検鏡で雌雄前核や第2極体の放出がみられると正常受精と判断されます。この段階で前核が3個以上認められる場合は、多精子受精であるので、除外する必要があります。
発育を開始した胚は、採卵後1日目に2細胞期胚になります。分割を繰り返して採卵後2日目に4細胞期胚、3日目に8細胞期胚を経て、4日目に桑実胚、5日目に胚盤胞に至ります。最近では、タイムラプスシステムにより胚の観察のために培養器から取り出すことなく、培養器内で胚の分割を連続して録画観察できるようになりました。
培養液
培養液は胚と直接、接して発育に必要な物質を供給するとともに、不要な物質を吸収する働きがあり、その後の胚発育に影響を及ぼす重要なものです。
これまで培養液は、1985年にQuinnらにより、ヒトの卵管液(Human Tubal Fluid, HTF)を基本として作製されました。ところで、胚の発育に必要な物質は8細胞期胚までと8細胞期胚以降で異なります。当時のHTFは8細胞期胚までの体外培養を前提にしており、3日目の8細胞期胚で胚移植が行われていましたが、1996年にGardnerらが、初期胚培養用と後期胚培養用で異なる連続型培養液 (Sequential Medium) を開発し、胚盤胞までの胚培養を可能にしました。これにより、胚盤胞までの培養が普及し、妊娠率の向上とその後の単一胚移植による多胎率の減少につながりました。
さらに、胚が必要とするエネルギー源や物質は胚自身が選択・吸収し利用するので、受精から胚盤胞まで同じ組成の培養液で良いとする考え方から、受精以降1つの培養液(Single Medium)を用いることも多くなりました。最近では、タイムラプスシステムにより、観察のために胚を培養器から取り出さなくてもよくなったことから、Single Mediumを用いることで、受精から胚移植まで培養器を開閉することなく、培養器内の温度や酸素濃度の変化を最小限に抑えることが可能となりました。しかし、Single Mediumでは胚の代謝後の老廃物やアンモニアが蓄積し、胚に悪影響を及ぼす可能性も指摘されています。
培養環境
卵子や胚は培養液の温度やpHの変化に対して敏感です。至適温度やpHから変動した培養条件では、受精率の低下、胚発育の遅延や妊娠率の低下がみられるため、培養器内の温度は37℃で培養液のpHは7.2〜7.4に調整されています。
卵管や子宮内の酸素濃度は2〜8%と通常の大気中の酸素濃度の20%と比較して低酸素状態であり、培養器内の酸素濃度は5%となるように設定されています。そのため、培養器には、二酸化炭素ガスと窒素ガスを注入することで5%酸素、5%二酸化炭素、90%窒素の状態に維持されています。
以前は1〜2mlの培養液で胚培養が行われていましたが、最近はマイクロドロップ(20〜250µl)の少量の培養液で培養されることが多くなりました。培養中に培養液中の水分の蒸散が起こると、培養液の浸透圧が高くなり、胚発育に影響がみられます。蒸散を防ぐために、培養器内の湿度を高く保つこと、また培養液の表面はミネラルオイルで覆うことが行われています。
また、胚発育に対する光の悪影響が知られており、胚の観察のために培養器から取り出す際には、紫外線の影響を防ぐために、培養室の蛍光灯は消灯します。また、タイムラプスシステムでは、影響の少ない長波長の光が使用されています。 複数胚を同じ培養液で培養すると、胚発育が良好になることが知られており、一つの培養ディッシュに複数の胚を入れるグループ培養が行われています。
胚発育の評価
体外受精胚の評価は形態学的な評価が行われてきました。4〜8細胞期のVeeck分類、胚盤胞のGardner分類が最も多く使用されてきました。しかしながら、良好胚でなくとも妊娠する例もあり、胚移植後の妊娠率とある程度の相関は見られるものの、完全ではありませんでした。
その後、タイムラプスシステムの普及により、連続的に胚発育を観察することが可能となり、これまでの形態学的観察よりかなり正確に胚の評価ができるようになりました。タイムラプスシステムの評価では、媒精から2細胞期、3細胞期、4細胞期、5細胞期に至るまでの時間と良好胚の相関が高いことなどが明らかとなり、この評価を元に移植胚を選択することで、妊娠率が20%向上するとの報告もあります。
熊本総合病院 婦人科
岡村 佳則
凍結方法
卵子、胚および精子に対し臨床応用されて久しい細胞凍結保存技術の進歩は、生殖補助医療の治療成績の向上に寄与しており、日本産科婦人科学会からも、凍結胚および卵子を用いた治療が年々増加傾向にあることが、体外受精・胚移植等の臨床成績実施成績にて報告されています。
卵子および胚の凍結保存法として緩慢凍結法とガラス化保存法の2種類があります。
緩慢凍結法とは、はじめに低濃度の凍結保護物質を含む溶液で処理して凍結保護物質を細胞内に浸透させ、プログラムフリーザーと呼ばれる機械を用いて徐々に(1分間に-0.5℃程度)冷却するもので、細胞外に氷晶が形成されるので細胞内を脱水することができます。細胞内が脱水されると、細胞内の凍結保護物質濃度が上昇し、細胞内の凍結保護物質濃度が50%以上となったところで、細胞を液体窒素下に投下し、急速に冷却します。これにより、細胞内に氷晶を形成させずに凍結することができます。
緩慢凍結法の初めての成功例は1971年および1972年にWhittinghamらによりマウス胚でなされました。ヒト体外受精において緩慢凍結法が導入されたのは1983年(Trounson and Mohr, 1983)、その後、世界中で緩慢凍結法による胚の凍結保存が実施されるようになりました。
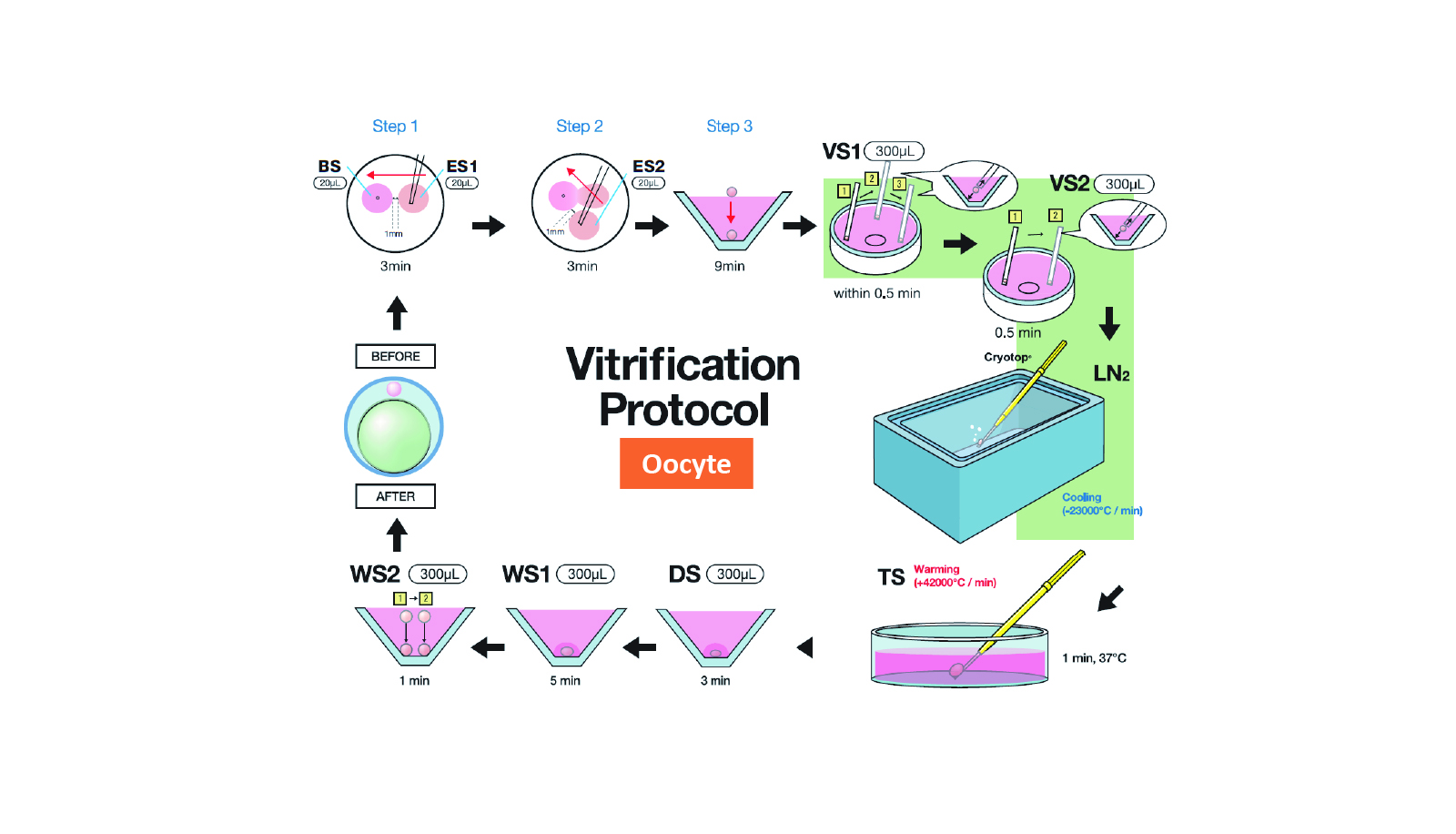
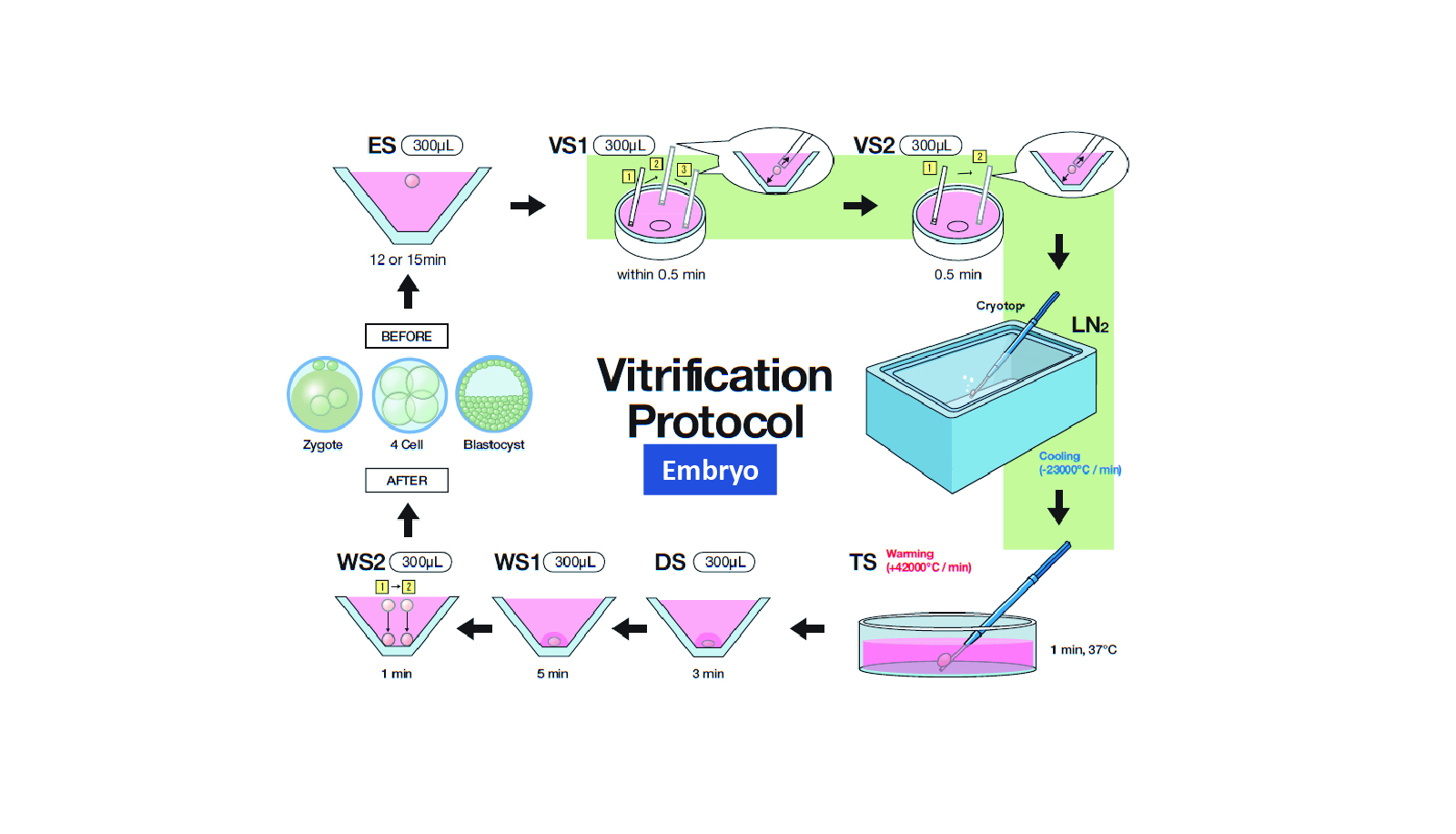
ガラス化保存法は高濃度の凍結保護物質を含む溶液に細胞を短時間浸透させた後、直ちに液体窒素に投入し急速に冷却させることで、細胞内外をガラス化する方法です。ガラス化とは細胞内外を原子配列が不規則で結晶構造を取らない非結晶状態に固化することをいいます。ガラス化保存法は1985年にRallらによってマウス胚で確立されました。ガラス化保存法の登場により、緩慢凍結法で必要であったプログラムフリーザー等の高額な機器を要せず、また、凍結に要する時間も緩慢凍結法での2時間から、20分程度に短縮できるようになりました。ガラス化保存法における凍結融解後の生存率、発生率は、緩慢凍結法と比較して高い成績が得られることから、Rallらの報告後、胚の凍結保存ではガラス化保存法が主流となりました。畜産分野ならびに生殖補助医療分野で応用されています。
卵子の凍結保存では、緩慢凍結法において1977年にマウス (Whittingham, 1977)、1979年にラット (Kasai et al., 1979)、1986年ヒト(Chen, 1986)での成功例が報告されました。一方で緩慢凍結法により凍結保存されたヒト卵子の妊娠率は低く、臨床応用するには十分ではありませんでした。卵子は細胞質が大きく、凍結融解を行うと細胞質内に氷晶形成が起こりやすいなど、胚と比較して凍結融解による障害を受けやすいためと考えられています。
その後、ガラス化保存法を用いることにより凍結融解後のマウスおよびヒトの成熟卵子の発生能が改善され (Kuleshova et al., 1999, Nakagata, 1989)、また、ヒトでは緩慢凍結法と比較しガラス化保存法の方が高い生存率並びに妊娠率妊娠率が得られることも報告されています。生殖医療分野においては、卵子に対する凍結保存法としてガラス化保存法が主流となりました。
ヒト卵子凍結保存の臨床応用への現状に関して、ガラス化保存法は米国、スペイン、南米などの卵子提供プログラムにおいて多く用いられるようになりました。しかし、2008年に米国生殖医学会(American society of reproductive medicine: ASRM)がガイドラインを発表、その内容は、ガラス化保存法を用いた卵子凍結の有用性は認めるものの、技術の安全性に関するデータの集積が必要とのことから、臨床研究として行われるべきであるとのことでした。
その後、諸外国よりガラス化保存法を用いた卵子凍結の報告を検討、ASRMはガラス化保存法が安全な技術であることを確認したと結論付けました。卵子凍結はもはや臨床研究段階ではなく、臨床応用として可能であるとの新たなガイドラインを2012年に発表しました。また、そこには、この卵子凍結技術は今後がん患者のための妊孕性温存治療の手段として用いられていくと記載されています。さらに、2013年ならびに2018年に米国がん学会(American society of clinical oncology:ASCO)より発表されたがん患者に対する妊孕性温存に関するガイドラインにおいても、がん患者はがん治療前に妊孕性温存についての説明を受けることが望ましいとしています。がん患者に対する妊孕性温存治療としての卵子および胚の凍結保存への関心がさらに一層深まりつつあります。
がん患者に対する妊孕性温存治療として、一般的には未婚の女性に対して卵子保存、既婚の女性に対して胚の保存を行います。採卵で得られた卵子の周りには卵丘細胞が付着しています。卵子保存では、その卵丘細胞を完全に除去後、直ちに凍結保存を行います。
一方、胚の保存では媒精方法により卵子の処理は異なります。体外受精(IVF)を行う場合は、卵子の卵丘細胞を取り除くことはせずに精子と共培養します。卵細胞質内精子注入法(ICSI)を行う場合は、卵丘細胞を完全に除去した卵子の卵細胞質内に精子を直接注入します。受精した卵子は数日間培養後、凍結保存を行います。卵子および胚の凍結保存(ガラス化保存)の方法に関しては、様々な製品、プロトコールが存在しますが、その中で最も多く使用されているCryotop法(北里コーポレーション社)の概略図を図1、 2に示しました。詳しい方法につきましては、当ホームページの妊孕性温存方法、卵子凍結、胚凍結のコラムをご参照ください。
加藤レディスクリニック
加藤 恵一(藪内)